Fasano’s triade en het traject van auto-immuniteits ziekten
Er wordt naarstig gezocht naar nieuwe strategieën om auto-immuunziekten te bestrijden nu steeds meer ouderen en jongeren er het slachtoffer van worden. Het is al lang bekend dat genetische en omgevingsfactoren auto-immuunziekten kunnen uitlokken. In 2000 stelde onderzoeker en clinicus Alessio Fasano, MD, een derde element voor – de permeabiliteit van de darmen1, beter bekend als lekkende darmen.
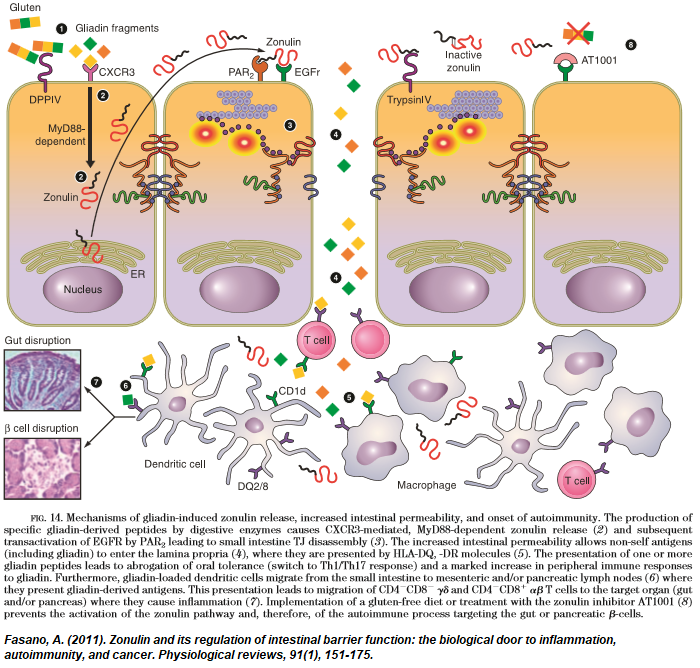
Dr. Fasano ontdekte een eiwit, zonuline, dat vrijkomt als reactie op een genetische of omgevingsprikkel. Hij suggereerde dat het een verdedigingsmaatregel zou kunnen zijn, een middel om de dunne darm te ontdoen van aanvallende micro-organismen.2 In niet-opgeschoonde toestand verandert het eiwit de structuur van de intestinale epitheliale tight junctions (TJ’s).2 Verzwakte TJ’s maken de passage mogelijk van antigenen – macromoleculen, toxines, voedseleiwitten, of andere – van de darm naar het lichaam: intestinale permeabiliteit. Fasano stelt zonuline voor als een hoofdregulator van de darmpermeabiliteit die de deur opent naar verschillende chronische ontstekingsziekten.3
Belgische onderzoekers sluiten zich aan bij het onderzoek van Fasano en merken op dat het darmepitheel een “cruciale reguleringsplaats van aangeboren en adaptieve immuniteit is. “4 Zonuline wordt in overvloed aangetroffen bij reumatoïde artritis, systemische lupus erythematosus, prikkelbaar darmsyndroom en andere auto-immuunziekten.4 Door zonuline als biomarker voor lekkende darmen te gebruiken, hebben onderzoekers van de Universiteit van Florida onlangs de aanwezigheid ervan in verband gebracht met leeftijdsgerelateerde ontsteking en broosheid (verminderde spierkracht). 5Strategieën om zonuline te verminderen zouden moeten leiden tot betere resultaten bij onze groeiende oudere bevolking door een gezond verouderingsproces te ondersteunen.
Inzicht in de rol die zonuline speelt bij de ontwikkeling van coeliakie biedt ook mogelijkheden voor behandeling, bijvoorbeeld met een geneesmiddel om de afgifte van zonuline te onderdrukken. Onderzoekers van de Mayo Clinic melden bijvoorbeeld gunstige in vitro-studies waaruit de werkzaamheid blijkt van een synthetisch peptide (ontdekt door Fasano), AT1001 of larazotide-acetaat, bij het reguleren van de darmpermeabiliteit.6
Naast bepaalde bacteriën is ook gliadine een belangrijke oorzaak van het vrijkomen van zonuline.2 Naar aanleiding van dit feit hebben Italiaanse onderzoekers met succes het probioticum Lactobacillus rhamnosus GG gebruikt om te verhinderen dat gliadine de darmpermeabiliteit verandert.7 Dit onderzoek draagt bij tot een groeiende hoeveelheid bewijsmateriaal waaruit de werkzaamheid van gezonde bacteriën blijkt bij de behandeling van de chronische ontsteking die een rol speelt bij auto-immuunziekten.
Het tegengaan van de factoren die leiden tot auto-immuunziekten – de triade van darmpermeabiliteit, genetica en omgevingsfactoren – kan een veelzijdige behandeling vereisen. Indien succesvol, zou deze aanpak niet alleen de symptomen van auto-immuunziekten kunnen verlichten, maar in veel gevallen ook kunnen leiden tot het omkeren van de ziekte.
References
- Fasano A. Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer. Physiol Rev. 2011;91(1):151-175. doi:10.1152/physrev.00003.2008.
- Fasano A. Zonulin, regulation of tight junctions, and autoimmune diseases. Ann N Y Acad Sci. 2012;1258:25-33. doi:10.1111/j.1749-6632.2012.06538.x.
- Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016;4(4):e1251384. doi:10.1080/21688370.2016.1251384.
- Vanuytsel T, Vermeire S, Cleynen I. The role of haptoglobin and its related protein, zonulin, in inflammatory bowel disease. Tissue Barriers. 2013;1(5):e27321. doi:10.4161/tisb.27321.
- Qi Y, Goel R, Kim S, et al. Intestinal permeability biomarker zonulin is elevated in healthy aging. J Am Med Dir Assoc. 2017;18(9):810.e1-810.e4. doi:10.1016/j.jamda.2017.05.018.
- Khaleghi S, Ju JM, Lamba A, Murray JA. The potential utility of tight junction regulation in celiac disease: focus on larazotide acetate. Therap Adv Gastroenterol. 2016;9(1):37-49. doi:10.1177/1756283X15616576.
- Orlando A, Linsalata M, Notarnicola M, Tutino V, Russo F. Lactobacillus GG restoration of the gliadin induced epithelial barrier disruption: the role of cellular polyamines. BMC Microbiol. 2014;14:19. doi:10.1186/1471-2180-14-19.
